免疫のメカニズムの解明によって、現在は、多くの感染症に対してワクチンや血清療法などの予防・治療法が確立しています。しかし、一方で免疫の働きそのものが引き起こす、アレルギー疾患や自己免疫疾患については、有効な予防・治療法が確立していない領域が多いのが現状です。慶應義塾大学の小安先生にアレルギー疾患、自己免疫疾患に関する研究の現状とこれからをおうかがいしました。
体を守る抗体IgEが無害な物質にも反応
――どのような原理で、アレルギー疾患は起こるのでしょうか。発生のメカニズムを教えてください。
アレルギー疾患発生の主な要因となる物質は、抗体の一種であるIgEです。本来、IgEは外からの微生物に対する防御壁になるもので、特に寄生虫の感染防止には有効。たとえば、お腹の中に線虫などが寄生すると、体内で増え、もう一度その寄生虫が入ってきた時に排除します。
しかし、このIgEがアレルギーでは問題となります。IgEは、全身に分布する白血球の一種である肥満細胞と非常に強く結合する性質をもっています。さらに、そこに花粉、食べ物などの抗原が結合すると、肥満細胞が活性化されて、肥満細胞の中にあるヒスタミンなどのかゆみ物質、あるいは血管を拡張する物質、平滑筋に作用する物質などが出ます(図1参照)。
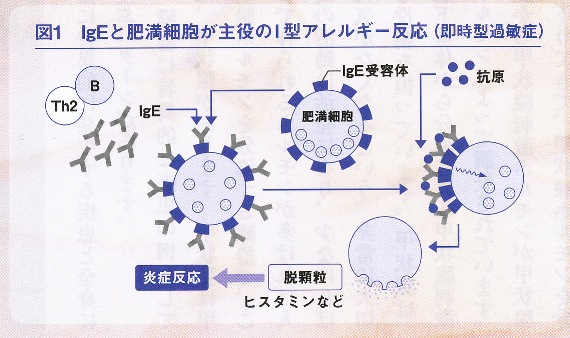
それが局所であれば、かゆみやじんましん、気道であれば、ぜんそくのような症状を引き起こすのです。全身の血管が拡張して血圧が急激に下がり、気道が収縮して呼吸困難に陥るというアナフィラキシーショックもそのひとつです。
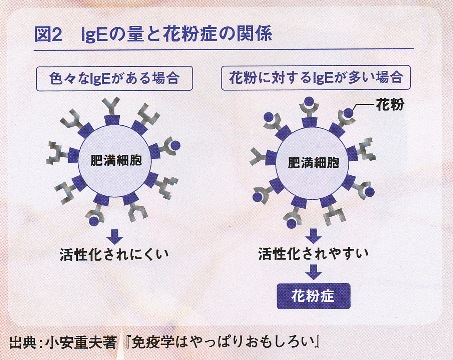
ただし、IgEの多さが即アレルギーにつながるわけではありません。IgEは、体の中で、肥満細胞に複数結合した状態になっていますが、このとき、肥満細胞に結合しているのがさまざまな物質に対応した多様なIgEであれば問題はないのです。問題なのは、たとえば、花粉に対するIgEばかりになる状態。そうなると、わずかな花粉の侵入に過剰な反応をしてしまいます(図2参照)。
環境と遺伝が抗体に影響した可能性
――なぜIgEは花粉などに反応してしまうのでしょうか。
原因はまだ正確に分かっていません。ここからは推測も加えた話になりますが、
要因として大きいのは遺伝と環境だと考えられます。
遺伝的な要因については、たとえば、同じようにスギ花粉の多い環境で生活していても、発症する人としない人がいます。その違いにはその人の遺伝的な特性が影響していると考えられます。今は疾病と遺伝子の関係性に関する研究も盛んに行われています。その人に何か特定の遺伝子があるからといって、必ずアレルギーになるというわけではありませんが、いくつかの遺伝的条件がそろえば、アレルギー発生の確率が高まるという傾向は次第に明らかになってくると考えられます。
環境の要因としては、車の排気ガスなどによる大気汚染が特定の物質に対するIgEを増やす方向に影響するという考え方が以前からあります。加えて、私が感じるのは生活環境の変化です。つまり、IgEが本来対応すべき寄生虫が先進国を中心に減少したことが影響しているのではないかという考えです。私の子どもの頃はギョウ虫の検査を頻繁に受けさせられましたし、虫下しを飲む人もいました。しかし、今はそんなことはありません。かつては寄生虫排除などで重要な役割をもったIgEですが、寄生虫に対するIgEがつくられない中で、本来は害のない花粉などに反応するようになったのではないかと考えられます。遺伝や環境が免疫系に影響を与えるメカニズムの解明は今後の大きいな研究課題です。
自分と外部の違いを認識する難しさ
――自己免疫疾患発生のメカニズムについても教えてください。
免疫系には本来、
自分の細胞とそれ以外を見分けて、外から入ってきたもののみを攻撃するという機能が備わっています。しかし、実は自分と外部との間にそれほど明確な違いはなく、自分と似たようなものは外部にはたくさんあります。免疫系がそれらにも対応していく機能を獲得する中で、
結果的に自分の細胞にも反応するようになったのだと考えられます。それ以外に、なかなか自己免疫疾患の説明はつきません。現実には、多くの患者さんが、自分の細胞に対する抗体ができ、大変な思いをされています。
自己免疫疾患にもたくさんの種類があり、大きく分けると、特定の
臓器に特異的に発生する疾患と
全身に及ぶパターンがあります。
臓器に特異的な疾患の例は、甲状腺があります。甲状腺は甲状腺ホルモンを分泌する臓器で、ここで作られるホルモンが多ければ人間の活動は活発になり、少なければ元気がなくなるという、非常に大切な役割を担っています。甲状腺は脳下垂体から分泌される甲状腺刺激ホルモンによって調製されています。脳から甲状腺刺激ホルモンが甲状腺に下りてきて、甲状腺ホルモンを分泌する司令を出し、ある程度増えた段階で、また脳に戻り分泌にストップをかけます。
ところが、自己免疫疾患の場合、下りてきた甲状腺刺激ホルモンを受け取る受容体に対して抗体が出来てしまうことがあります。そうなると、ひとつのパターンとしては、その抗体が受容体と結合した刺激によって甲状腺ホルモンが過剰に分泌される現象が起こります。この場合は刺激しているのが抗体ですから、分泌は止まりません。増えた甲状腺ホルモンにより体が異常に活発になり、熱が出て心臓がドキドキするようになります。これがバセドー病です。
もうひとつのパターンとして、受容体と結合しても抗体が甲状腺ホルモンを生産する刺激が起こさないこともあります。この場合、甲状腺ホルモンの不足で、元気がなくなってしまいます。こちらは橋本病といわれるものです。
こうした臓器に特異的な疾患に対して、自己免疫疾患の中には全身にわたって起こるものもあります。たとえば、体内の免疫の働きで炎症が次々と起こった結果、関節が腫れて動かなくなる、リウマチもそうです。これが何をきっかけに起こるのかはいまだに分かっていません。
ただ、近年の研究で炎症が進むプロセスに、免疫系のホルモンともいうべきサイトカインの数種が影響していることが分かりました。特に
炎症を誘発するサイトカインを中和する抗体を投与することで、症状改善が見られたという例も出ています。
こうした研究をもとに開発されたのが、自己免疫疾患治療で使われ始めている生物製剤です。現象発生のきっかけはいまだに分からないものの、炎症のサイクルを緩和することで治療につながるということです。今後の研究の進展が待ち望まれます。
全身にわたる自己免疫疾患に似た疾患として、自己炎症というものもあります。免疫系には侵入した物質と体内で自ら作り出した物資の違いを認識する機能がありますが、それがうまく働かず、体内で作られたものを外部から侵入したと認識することによって炎症が起きる現象です。典型は尿酸の結晶に反応して炎症を起こす痛風です。
この自己炎症の研究において、炎症が発生し易いかどうかが腸内細菌の構成によることが明らかになってきています。
それはマウスでの実験を通じて、炎症を起こす個体と起こさない個体を調べると、その違いが腸内細菌にあることが分かったためです。さらに炎症を起こした個体、起こさない個体の両方の腸内細菌をそれぞれ別の無菌マウスに移すと、やはり炎症を起こした個体から移したマウスには炎症が見られ、もうひとつには炎症が見られませんでした。さらに、腸内細菌のうちどれがどう影響するのかについての研究も進められており、将来は人間の腸内細菌を使った研究に発展する見込みです。
これからの研究成果に大きな期待
――アレルギー疾患、自己免疫疾患でなかなか有効な治療法が確立されていない分野が多いのはなぜでしょうか。
ほとんどの分野においてある程度メカニズムが分かってきていますが、それをもとにした有効な治療法が見つかっていないのが現状ではないでしょうか。たとえば、アレルギーでいえば、IgEと肥満細胞を結合さえさせなければ、症状が出ないことは分かっています。しかし、結合する力があまりに大きいこともあり、それを防ぐ方法が見つかっていません。
――将来はより有効な治療法が確立されるのでしょうか。
アレルギー疾患については今いろいろなアプローチが試されています。
たとえば、アレルギーが発生する前に、人為的に感染症への免疫反応を起こすことによって、特定の物質に 反応するIgEが増えないようにする治療法の研究が国内外で進められています。アレルギーに対するワクチンのようなものです。また、体内に入った花粉をすぐに他の抗体と結合させ、IgEに到達させないようにするという治療法も研究されています。これらがうまくいけば、有効な治療法として実用化されていくのではないでしょうか。一方、自己免疫疾患については、先ほど話に出た生物製剤をいろいろな疾患に応用するための研究が始まっています。
ただ、難しいのは臓器特異的タイプです。これは発生のきっかけは分かっているものの、どうしたら防止できるのかが分かっていません。
このように
すべての疾患をクリアできるわけではありませんが、いくつかの領域では希望の持てる研究が続けられています。その成果によって将来、治療法は大きく進化すると思います。
2010年、ナチュラルヘルパー細胞の発見
アレルギー疾患の治療に貢献できる可能性も
小安先生の研究室では2010年1月、マウスの腸内の近くの脂肪組織から、免疫を活性化させるたんぱく質を大量に作り出す新種のリンパ球「ナチュラルヘルパー(NH)細胞」を発見したと発表しました。
増えすぎると花粉症や食物アレルギー、ぜんそくなどを起こす要因のひとつとなると考えられるたんぱく質である複数のTH2サイトカインが、この細胞によって大量に作られることがわかっており、将来、花粉症やアレルギー疾患を予防・治療する手がかりになると期待されています。
小安先生は「私たち自身も今のような時代に新しい細胞を発見できるとは思っておらず驚きました。これから数年の研究が必要になると思いますが、この細胞を防御できるようになればアレルギー疾患の要因となるサイトカインの増加を抑え、症状を緩和することができるかもしれないと期待しています」と話されました。
慶應義塾大学医学部教授(微生物学・免疫学教室) 小安 重夫先生
プロフィール
1978年東京大学理学部生物化学科卒、同大学院。1981年(財)東京都臨床医学研究所研究員。1988年からハーバードメディカルスクール、ダナ・ファイバー癌研究所においてポスドクトラルフェロー、助手、助教授、准教授。1995年から慶応義塾大学医学部教授(微生物学・免疫学教室)。
Pl3キナーゼを中心とした免疫系のシグナル伝達研究、樹状細胞の機能研究、などいくつかのテーマを掲げている。特に、ダイナミックな免疫系の機能を解析できるという点で感染免疫に惹かれ、宿主と寄生虫の両方において遺伝学と分子細胞学の手法を駆使して宿主寄生体の相互作用を理解すべく研究を続けている。
![]()