原発性アルドステロン症の1例
(提供:東北大病院腎・高血圧・内分泌科講師の佐藤文俊氏)
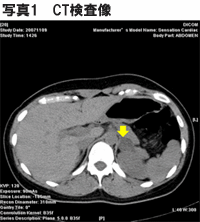
CT検査で長径23mmの左副腎結節が確認された。ただし、副腎静脈サンプリングにより結節は非機能性と判明した。CT検査で確認された腺腫が非機能性であるようなケースは少なくない。
■症例 32歳、女性。
■主訴 夜間尿を伴う高血圧
■既往歴 2型糖尿病、気管支喘息
■現病歴 27歳時から高血圧を指摘されており、CT検査(写真1)で左副腎に長径約2cmの腫瘍を指摘されたため、精査目的で2007年10月に当科紹介。
■経過 外来でのカプトリル負荷試験等で原発性アルドステロン症と確定診断。2008年1月、副腎静脈サンプリングを施行し、CT検査で確認された長径23mmの左副腎結節は非機能性であり、アルドステロン過剰の局在は右副腎であると診断した。
本人の都合もあり同年7月に右副腎の摘出術を施行。術後の病理診断およびステロイドホルモン合成酵素の免疫組織化学的検討により、長径2mmの微小アルドステロン産生腺腫を確認した(写真2)。
術前に抗アルドステロン薬のエプレレノン100mg、カルシウム拮抗薬、アンジオテンシンII受容体拮抗薬、α1阻害薬を要したが、術後は降圧薬は不要となり、家庭血圧は110/70mmHg台となった。1年後の外来時もBP118/74mmHgであった。
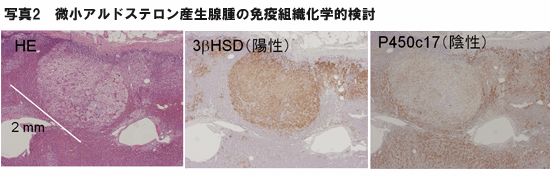
右副腎の摘出術後の免疫組織化学的検討で、長径2mmの微小アルドステロン産生腺腫は3βHSDの発現は陽性、P450c17の発現は陰性で、アルドステロン産生の条件を満たしていた。
![]()
![]()

![]()
![]()
